A revolução genética
As vacinas de RNA contra a Covid-19 são o símbolo do mergulho cada vez mais fundo da medicina em nosso genoma. Bem-vindo a esse admirável mundo novo

A vida gira em torno dos genes. Para alguns pensadores da evolução biológica, como Richard Dawkins, no fundo, no fundo, são eles que realmente importam… e perpetuam indivíduos e espécies. Pode ser você, podem ser as bactérias do seu intestino, pode ser a costela-de-adão que embeleza sua sala, pode ser essa praga chamada coronavírus: todos somos feitos de genes. Dentro das células humanas, existem minúsculas fábricas que funcionam sem parar, transformando códigos genéticos em mais de 20 mil tipos de proteínas que darão origem a hormônios, ossos, fios de cabelo, anticorpos e grande elenco. A receita para tudo isso e muito mais está guardada no DNA, sigla que há décadas deixou de ser um mistério e hoje é o epicentro de uma revolução na medicina. Agora, não apenas conhecemos falhas genéticas capazes de desorganizar o organismo e causar doenças como podemos flagrar algumas delas e até tratá-las, salvando vidas antes sem esperança.
O DNA não é a única sigla que faz história. No corpo humano, os genes só cumprem sua função graças ao RNA mensageiro, um componente que traduz a informação original, copia seu passo a passo e vai ao chão de fábrica instruir os operários a confeccionar proteínas. Outros tipos de RNA participam do processo, mas foi essa categoria que ganhou os holofotes na pandemia do coronavírus — patógenos que, veja só, são feitos apenas de RNA —, quando o mundo assistiu ao mais rápido desenvolvimento de vacinas da história.
Tudo começou com uma ideia fora da caixa, não exatamente nova, mas antes utópica. Ora, se esse sistema funciona tão bem, por que não simplesmente hackeá-lo a nosso favor e fabricar ou interromper o que bem entendermos? Duas vacinas de alta eficácia contra a Covid-19, a da Moderna e a da Pfizer/BioNTech, fazem exatamente isso: nos apresentam um RNA “pirata”, que manda nosso organismo produzir uma proteína do coronavírus, então reconhecida pelo sistema imune. Se o vírus entra em contato com a gente, a defesa contra ele já está armada.
“O sucesso dessas vacinas abre um grande campo para lidar com outras doenças, porque podemos enviar às células ordens para fabricar anticorpos que combatem um tipo de câncer ou desenvolver resistência a substâncias liberadas em distúrbios autoimunes”, diz a bioquímica húngara Katalin Karikó, vice-presidente da BioNTech e pioneira nos estudos com RNA mensageiro. É, em parte, graças ao trabalho incansável e discreto dessa cientista, que chegou a ter pedidos de financiamento negados por causa das dúvidas sobre a sua abordagem, que agora se vislumbra um fim para a pandemia de Covid-19. Katalin integra um extenso time de pesquisadores que, com resiliência, vem há anos decifrando enigmas biológicos e desbravando terrenos onde se semeia o futuro da medicina.
Além da descoberta em tempo recorde de quem é e de como se comporta o Sars-CoV-2 e da inauguração da nova geração de vacinas — que contempla os imunizantes de vetor viral, como o de Oxford/ Fiocruz, o da Johnson & Johnson e a russa Sputnik V, também feitos via manipulação genética —, o avanço na genômica abriu as portas às primeiras terapias que corrigem de uma vez por todas defeitos no DNA, alguns deles capazes de levar crianças à morte. E muitas ideias que parecem saídas de livros de ficção já estão em testes avançados, nutrindo a perspectiva de aprimorar o tratamento de problemas tão frequentes como a pressão alta. Genética não é bola de cristal nem panaceia, mas, aliada à ciência de dados e à sensibilidade do cuidado médico, é provavelmente dela que virão respostas e soluções para os males de hoje e de amanhã.
Glossário genômico
Um guia para os termos que serão utilizados nessa matéria.
Ácido nucleico: moléculas que codificam e traduzem proteínas. São duas, o ácido desoxirribonucleico (DNA) e o ácido ribonucleico (RNA).
Bases nitrogenadas: compostos representados pelas letrinhas A, C, G, T e U, que se ligam para formar o ácido nucleico (DNA ou RNA).
Cromossomo: guarda sequências de genes. Temos 46, metade herdada de cada genitor.
Deleção: trecho deletado da sequência do código genético.
Exoma: a sequência de DNA responsável por codificar proteínas — os 21 mil genes conhecidos no Projeto Genoma Humano.
Expressão gênica: medida da atividade do gene, traduzida na produção de uma proteína.
Gene: sequência de nucleotídeos que guarda a receita para a produção de uma proteína.
Genoma: a sequência completa de genes que compõem um organismo.
Nucleotídeo: bloco construtor do DNA, formado pelas bases nitrogenadas, um açúcar e um ácido fosfórico.
Proteínas: moléculas cuja receita está nos genes, compõem tecidos e conduzem praticamente tudo o que acontece no organismo.
Sequenciamento: leitura num aparelho de trechos do DNA ou do genoma inteiro.
Variante, ou mutação: mudanças na sequência das letrinhas que alteram a estrutura de um gene.
A ideia por trás das vacinas mais rápidas da história
No dia 16 de março de 2020, nos Estados Unidos, uma vacina experimental contra o coronavírus foi aplicada pela primeira vez em humanos. Elaborado pela Moderna, o imunizante não só foi o mais veloz já produzido, aplicado menos de três meses após a China anunciar um vírus novo por trás de pneumonias severas naquele país, como seria um dos primeiros aprovados no planeta, estreando uma tecnologia inédita, a do RNA mensageiro. A Moderna, até então, era uma startup promissora, que recebera investimentos maciços, mas não tinha nenhum medicamento no mercado ou aplaudido pela comunidade científica.
Pouco tempo depois, em abril, a Pfizer, um gigante dos laboratórios, anunciou o início dos testes clínicos com sua própria vacina. A tecnologia veio da parceira BioNTech, empresa alemã que havia décadas penava para ter terapias aprovadas. Tanto a BioNTech quanto a Moderna nasceram com a ambiciosa meta de transformar células humanas em indústrias farmacêuticas, porém esbarravam em dificuldades homéricas: a entrega e a segurança das propostas. “O RNA é uma molécula muito frágil e delicada, que provocava uma resposta imune agressiva. Foram necessários anos de pesquisas para chegar a uma estrutura que realmente funcionasse”, conta a microbiologista Natalia Pasternak, presidente do Instituto Questão de Ciência (IQC).
O entrave entre teoria e prática, travado há pelo menos 30 anos, acontecia em parte justamente por causa dos vírus. Para muitos deles, o RNA é o próprio genoma, diferentemente do corpo humano, onde esse ácido nucleico executa tarefas em conjunto com o DNA. Dengue, influenza, Sars-CoV-2 e tantos outros nada mais são do que um emaranhado de RNA encapado por proteínas, que precisam sequestrar o sistema fabril das nossas células para fazer suas cópias. Por isso, nosso organismo possui um sistema de vigilância pronto, refinado ao longo de milhões de anos para detectar e barrar microinvasores com essa composição.
Como se intrometer, então, nesse esquema para descolar proteção contra uma doença até então desconhecida? O caminho não foi simples. “No início das pesquisas, lá atrás, ao inocular uma quantidade baixa de RNA, ele era degradado em segundos. Ao aumentar a dose, havia a produção de marcadores que recrutavam agentes de defesa, dando início a uma resposta inflamatória que poderia até levar à morte”, relata o microbiologista Luís Carlos Ferreira, diretor do Instituto de Ciências Biomédicas da USP, um dos pioneiros nos estudos nesse campo no país. A descoberta que mudou tudo aconteceu há cerca de 15 anos, na americana Universidade da Pensilvânia, onde atuava o grupo de pesquisa de Katalin, cotada inclusive para um futuro Prêmio Nobel.
“Durante nossas investigações, verificamos que outro RNA, o de transferência, não desencadeava tais reações”, lembra a bioquímica. A equipe passou, então, a fazer mudanças estruturais no RNA inspiradas nas alterações que viu nesses experimentos. “E, ao substituirmos uma molécula específica do RNA mensageiro, a uridina, notamos que ele deixava de produzir aquela resposta imunológica”, continua Katalin. A partir daí, sua trupe foi testando combinações e descobriu que outro composto parecido, a pseudouridina, era capaz de passar despercebido pelas células de defesa. Assim, foi só trocar um bloquinho do RNA por outro. Os testes animaram. Mas faltava resolver outro dilema: entregar um material tão sensível na dose e no lugar certos.
“Era preciso desenvolver nanopartículas carreadoras, capazes de sobreviver ao sangue e a diversas barreiras celulares”, conta o bioquímico Frederico Pittella, da Universidade Federal de Juiz de Fora (UFJF), que trabalha com carreadores desde seu doutorado em Tóquio, no Japão. Há um sem-fim de partículas de ouro, prata, carbono e afins em estudo, mas as que estão hoje nas vacinas são as que atingiram os melhores resultados: os lipossomas, uma espécie de cápsula de gordura. “É uma esfera oca, feita de um material que tende a se fundir com as células, mas protege o RNA da degradação de enzimas especialistas em detectá-lo”, explica Ferreira.
Quando a Covid-19 acendeu o alerta geral, os avanços de Katalin e companhia já eram colocados à prova em pesquisas clínicas contra outros vírus, como o HIV e os causadores da raiva e da gripe. Então por que não adaptar a estratégia para o Sars-CoV-2? Mãos à obra: os pesquisadores copiaram parte do material genético viral, montaram um RNA em laboratório, envolveram tudo naquele tipo de cápsula de gordura… e partiram para os testes!
Para quem está de fora, a rapidez do processo deu a impressão de que estavam correndo e pulando etapas, mas não: a receita estava pronta, bastava ajustá-la e avaliá-la em larga escala. O que mudou, claro, foi a urgência. A pandemia fez os bolsos mais recheados do mundo se abrirem, permitindo a produção de insumos, a contratação de pessoal, a ampliação de fábricas e a estruturação de estudos com milhares de voluntários. O êxito abriu caminho para o que era a ambição inicial dos pesquisadores: fabricar vacinas ou remédios com os ingredientes do corpo. “Essa é uma mudança de paradigma na ciência”, crava o bioquímico Carlos Menck, da USP.

As vacinas de RNA mensageiro já provaram ser eficazes em reduzir o risco de contrair a Covid-19 e apresentar os desfechos graves da doença, mas as pesquisas seguem firmes para investigar a duração da imunidade e as reações adversas — houve 21 crises alérgicas graves observadas nos EUA — e apurar se, além de impedir que o imunizado adoeça, ele também deixa de espalhar o vírus. Nessa toada, bem exitosa até o momento, é de esperar que doses com a mesma tecnologia despontem para combater outros micróbios. “Estamos trabalhando, por exemplo, em uma vacina universal contra a gripe, que protegeria contra as mutações do vírus influenza”, diz Ferreira. Em parceria com Norbert Pardi, colega de Katalin Karikó na Universidade da Pensilvânia, o brasileiro testou o imunizante em roedores, com resultados positivos.
Outra jornada promissora é a busca de vacinas não preventivas, mas terapêuticas, contra o câncer. O raciocínio é parecido: e se pudéssemos enviar às células a receita certinha para criar proteínas que suprimem a atividade dos tumores? O grupo de Ferreira na USP trabalha numa fórmula contra cânceres provocados pelo vírus HPV, que já está sendo testada em pacientes do Hospital das Clínicas de São Paulo. A indústria também arregaça as mangas. “A vacinação com RNA mensageiro pode apoiar o sistema imunológico do paciente com câncer”, analisa Pablo Umaña, líder de Desenvolvimento para Imunoterapia Oncológica da Roche. A farmacêutica explora, com a BioNTech, um produto que apresenta ao sistema de defesa do paciente até 20 substâncias secretadas por alguns tumores. “Isso ajuda células importantes na resposta imune a reconhecê-los”, esclarece Umaña.
O interruptor de genes
Falamos até aqui do tipo mais conhecido de RNA, o mensageiro. Acontece que ele é só o mais famoso representante dessa família de ácidos nucleicos. Mais tipos de RNA (siRNA, miRNA…), ainda menores e mais desconhecidos, de silhuetas diferentes da tradicional fita simples, participam do processo de traduzir a informação contida nos genes e levá-la às estruturas que produzem as proteínas. Sim, é complexo mesmo, e é por isso que a ciência tem mergulhado cada vez mais nessas partículas. “O funcionamento desses RNAs ajuda a entender por que alguns genes estão ativos em determinados momentos da vida, para formar o coração de um embrião ou degenerar os neurônios de um idoso, por exemplo, e estão inativos em todos os outros anos”, conta Melissa Markoski, doutora em biologia celular pela Universidade Federal do Rio Grande do Sul (UFRGS).
Foi em busca de resposta para esses mistérios que cientistas desvendaram, no final dos anos 1990, o mecanismo de interferência de RNA, ou RNAi. Trata-se de um processo que ocorre naturalmente nas células, por meio de pequenos fragmentos de RNA, programados para reconhecer e se ligarem a um RNA mensageiro que esteja no citoplasma. “Isso impede que ele seja lido pelos ribossomos e, consequentemente, evita a fabricação da proteína em questão”, descreve Pittella. Ou seja, se o RNA mensageiro está envolvido na ativação de um gene, por meio da transmissão das mensagens contidas nele, os RNAs de interferência fazem o contrário: interrompem a leitura de receitas específicas. Esse comportamento ajuda a determinar a expressão gênica, e conhecê-lo em detalhes é tão importante quanto destrinchar a sequência de bases nitrogenadas do genoma. Não à toa, o achado levou um Nobel em 2006, mas acabou caindo no ostracismo frente aos desafios técnicos na manipulação do RNA.
Mas a história, como você deve intuir, mudou. Desde 2018, já existem medicamentos baseados em RNAi no mercado, a maioria para doenças raras, que geralmente são causadas por problemas relacionados a apenas um gene, em locais específicos do corpo, mais facilmente atingíveis. Só que o escopo desse tipo de intervenção está se ampliando. “Há poucos anos, duas ou três empresas mexiam com isso; hoje são mais de 30, e estamos só no começo”, contextualiza Dan Peer, diretor do laboratório de nanomedicina da Universidade de Tel Aviv, em Israel, que prevê que em cinco anos devemos ver uma expansão significativa de testes clínicos com RNAi para tumores como de ovário e cérebro.
“Criamos sistemas de entrega mais eficientes, nos quais podemos conjugar com o RNA moléculas que são vistas e captadas por órgãos distantes”, relata Akshay Vaishnaw, presidente de Pesquisa e Desenvolvimento da Anlylam, empresa cujos fundadores participaram da descoberta do RNAi e uma das poucas que sobreviveram ao período de provação. Ela colhe os frutos da persistência. Em parceria com a Novartis, conseguiu aprovar há pouco na União Europeia o Leqvio, remédio que reduz o colesterol do jeito mais simples (e paradoxalmente complexo) possível. “Interceptamos o RNA que induz a fabricação de uma proteína-chave na síntese do colesterol no fígado”, resume Vaishnaw. O laboratório estuda, nessa linha, uma droga contra a hipertensão que seria administrada com uma única injeção por semestre. Já pensou?

Manipular o ácido nucleico para que ele conserte o que está errado no corpo é uma estratégia que poderá levar esperança a portadores de doenças que até agora não podem ser tratadas. As terapias de RNA representam, assim, a terceira grande geração de medicamentos — depois dos sintéticos, como analgésicos e antibióticos, e dos biológicos, caso dos anticorpos monoclonais. “O problema maior desses anticorpos é que eles conseguem neutralizar apenas proteínas que estão fora das células, e isso deixa de fora mais de 19 mil alvos intracelulares, incluindo alguns causadores de doenças”, argumenta Vaishnaw. No futuro, o RNA mensageiro pode inclusive facilitar a expansão de outras terapias gênicas, como as que corrigem o próprio DNA.
A terapia gênica já é realidade
Ela chegou pra valer ao Brasil em 2020. Diferentemente das estratégias que utilizam o RNA, esses tratamentos corrigem o gene defeituoso em si. Dois deles foram aprovados aqui: um para a atrofia muscular espinhal (AME), doença degenerativa que atinge bebês, e outro para a distrofia hereditária da retina (DHR), que causa cegueira irreversível. “Introduzimos no núcleo das células uma nova cópia do gene, que não se integra ao DNA, mas fica próximo a ele, e passa a realizar o trabalho do gene que está alterado nessas doenças”, explica Janaína Lana, diretora médica de terapias gênicas da Novartis Brasil, responsável pelos lançamentos. Ambas são de dose única e têm o potencial de impedir a progressão dos distúrbios e até curá-los.
O veículo de entrega dos genes saudáveis é um vetor viral inofensivo, parecido com aqueles usados em certas vacinas, e capaz de atingir o núcleo das células que não operam direito. Cabe ressaltar que o DNA é um centro de comando estável e praticamente impenetrável, com um sistema de reparo eficiente. As vacinas de DNA e RNA não são capazes de provocar mudanças nele — a de RNA não passa nem perto do núcleo. Mas alterações decisivas nessa área tão nobre podem acontecer por outras razões. Anos de exposição ao cigarro ou à radiação solar, por exemplo, levam a mutações perigosas, que são o ponto de partida para um câncer.
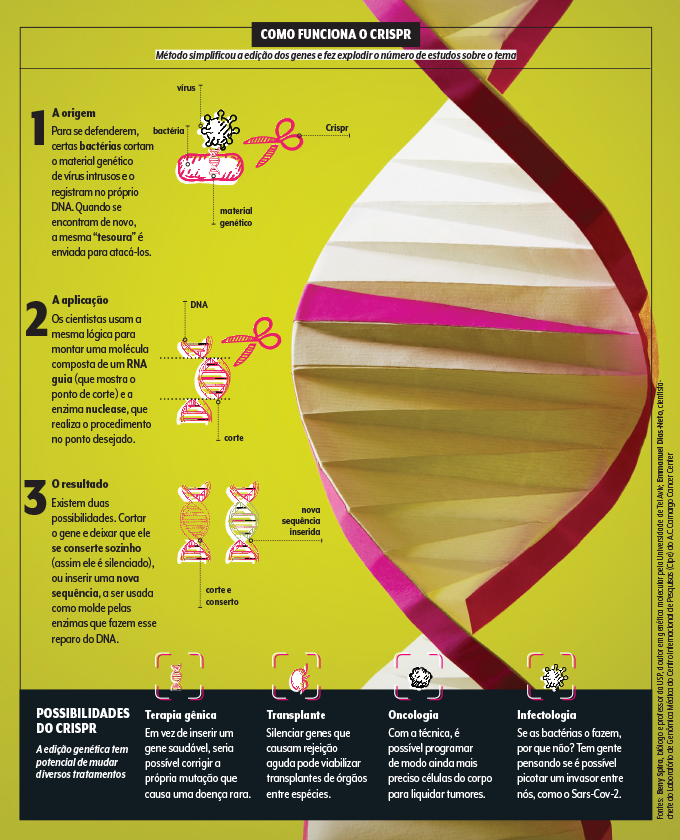
A busca por bons veículos para os genes deve florescer nos próximos anos, mas é provável que essa tática seja atualizada em um futuro não tão distante. “Para mutações pequenas e bem conhecidas, a tendência é que se use a edição genética, que corrige o próprio material genético da pessoa”, prevê a geneticista Ursula da Silveira Matte, professora da UFRGS. E, aí, quem brilha é outra sigla, o Crispr, que é o método de edição mais acessível e estudado. Os primeiros testes em humanos com a técnica começaram no exterior em 2020 para doenças do sangue como a talassemia. E é possível que, em breve, experimentos do tipo se repitam no Brasil visando a outros distúrbios raros. “Em estudos preliminares, conseguimos corrigir a mutação que leva a 80% dos casos nacionais de mucopolissacaridose [doença que causa malformação dos ossos e atraso no desenvolvimento mental]”, ilustra o bioquímico Guilherme Baldo, da UFRGS. Antes de partir para os humanos, a equipe gaúcha está se certificando de que apenas aquele trecho do DNA será alterado e a mudança é suficiente para prover benefícios sustentáveis. Os resultados prévios são animadores.
Desde que foi descoberto, em 2012, por duas cientistas que receberam um Nobel ano passado, o Crispr explodiu em popularidade. E até ele pode ser aprimorado pela expansão da técnica do RNA mensageiro. “Podemos, um dia, em vez de entregar o sistema Crispr pronto para o corpo, instruir a própria célula a fabricá-lo”, teoriza Peer. Espera-se, ainda, que essa técnica torne realidade outras ideias futuristas, como o xenotransplante, o transplante de órgãos entre espécies. É isso mesmo. “Hoje é possível silenciar os genes que causam a rejeição aguda de rins suínos, que têm tamanho e função semelhantes aos órgãos humanos, e poderiam ser usados para reduzir a fila dos transplantes”, explica o médico Silvano Raia, da USP.
Do alto de seus 90 anos, ele e a equipe já conseguiram realizar com sucesso as etapas de engenharia genética, e agora tentam viabilizar a construção do local que abrigaria os porcos gerados a partir de embriões modificados. A ideia é reduzir a enorme fila para transplantes renais no Brasil — são 133 mil pessoas dependendo de hemodiálise. Ousado, mas não é a primeira vez que Raia vai encarar ceticismos. Nos anos 1970, ele foi o primeiro médico a realizar um transplante de fígado entre duas pessoas vivas. “Era um tabu, diziam que eu estava ferindo o juramento da medicina, mas, no fim das contas, o método se mostrou muito válido”, relembra o professor.
E Raia não está sozinho nessa. Em dezembro de 2020, a FDA, agência que regula medicamentos e procedimentos nos Estados Unidos, aprovou o uso de porcos geneticamente modificados para fins terapêuticos. “Não é uma questão de se vai acontecer, mas quando”, observa Raia. O médico vislumbra um futuro promissor, só que ele depende de muito financiamento — algo inescapável para qualquer experiência genética de envergadura.
As terapias gênicas aprovadas no Brasil custam milhões de reais. São incríveis, é verdade, mas valores dessa ordem exigem toda uma reestruturação dos sistemas de saúde público e privado. Principalmente se pensarmos que essas novidades não vão tratar apenas doenças raras. Elas já estão mudando, na verdade, o tratamento de males tão comuns como o câncer. A edição genética alarga as fronteiras das terapias celulares, como a CAR-T, que reprograma as células de defesa de um paciente para atacar alvos específicos em tumores. “É o mesmo princípio da terapia gênica, mas fazemos isso fora do corpo, inserindo uma sequência artificial no genoma daquelas células”, explica a bióloga Virgínia Picanço e Castro, da USP de Ribeirão Preto. A técnica já foi aprovada para certas leucemias e linfomas nos EUA e deve chegar em breve ao Brasil — a Novartis planeja uma submissão à Anvisa neste ano. Será um processo delicado, que exigirá a exportação do material do paciente para turbinar suas células lá fora. É de imaginar que o custo fará jus à alta complexidade.
Além do grupo suíço e da Pfizer, Roche, Bayer e outras companhias de peso estão fazendo parcerias ou adquirindo startups inovadoras na área de terapias com DNA e RNA. E elas vão chegar. A dúvida é para quem. Escalonar a produção é uma saída para baixar o preço, só que esse é um baita desafio no caso das terapias gênicas e celulares, que demandam material biológico e, portanto, têm capacidade limitada. Os tratamentos à base de RNA, por sua vez, são mais facilmente manufaturados em larga escala, mas, tendo em vista o que já está disponível no mercado, ainda são caros.
Tecnologias made in Brazil certamente podem ampliar o acesso. E já temos progressos nesse sentido: a USP de Ribeirão Preto desenvolveu seu modelo de CAR-T. Em 2019, eles trataram com sucesso um homem com linfoma já desenganado. “Fazendo tudo aqui, barateamos o custo de produção das células”, argumenta o hematologista Rodrigo Calado. Ele e sua equipe conseguiram fundos para estruturar o laboratório e aguardam o arrefecimento da pandemia para testar a terapia em mais gente.
O mapeamento dos genes

Outra ferramenta que expande e torna cada vez mais úteis os achados sobre o genoma é o sequenciamento. Foi graças a ele, inclusive, que decodificamos o Sars-CoV-2, seus deslocamentos geográficos e as variantes que estão surgindo e podem ser mais transmissíveis. “Cada vez que o vírus passa de um indivíduo para outro, sofre algumas mutações. E, a partir da comparação entre amostras de diversos infectados, conseguimos analisar sua dispersão”, detalha a biomédica Jaqueline Góes, da USP, que faz parte da equipe que identificou, em menos de 48 horas, o código genético do primeiro caso no Brasil. E é por meio da chamada vigilância epidemiológica molecular que podemos flagrar precocemente os coronavírus mutantes que já pintam por aí.
“Infelizmente, porém, isso não foi feito de modo sistemático, o que nos leva a situações como a variante do Amazonas ter sido detectada apenas quando chegou ao Japão”, avalia o virologista José Eduardo Levi, da Dasa. Desenvolver uma estrutura do tipo nos ajudaria a enfrentar melhor esta e futuras pandemias, suportando decisões no momento oportuno, como impor medidas restritivas assim que a mutação perigosa é identificada. “Quando comparamos com outros países, vemos que esse trabalho ainda é restrito por aqui”, concorda a bióloga Deusilene Vieira, da Fiocruz de Rondônia.
Por fim, a popularização das análises genéticas é o capítulo que falta para desfrutarmos realmente de uma medicina de precisão. A ideia é cavucar nos genes riscos e respostas para prevenir doenças, diagnosticá-las mais cedo ou mesmo tratá-las da melhor forma. Acontece que essa tática está pautada hoje essencialmente nas informações colhidas no DNA de povos brancos e de origem europeia. “Já encontramos no Brasil milhões de variantes genéticas que ainda não estão descritas no mundo. A ideia é descobrir quais estão ligadas ao risco de doenças comuns entre nós”, relata a geneticista Lygia da Veiga Pereira, líder do projeto DNA do Brasil, que mapeou mil genomas brasileiros e pretende analisar mais 3 mil até o final de 2021. O Reino Unido, que se destacou pelo sequenciamento maciço dos casos de Covid-19, planeja destrinchar o DNA de 500 mil britânicos até 2024.
Ainda não temos as vacinas de RNA no país e as terapias gênicas podem soar como um sonho numa nação desigual como a nossa, mas talvez essa distância dos avanços lance luz sobre o tema, e ele receba a atenção que merece. Em nome inclusive da saúde pública. “Com o devido investimento, poderíamos testar milhares de casais em idade reprodutiva para verificar o risco de os bebês terem doenças recessivas e agir preventivamente”, exemplifica Mayana Zatz, coordenadora do Centro de Estudos do Genoma Humano da USP, cujo trabalho é mais um exemplo de que o Brasil tem muito potencial na área. É difícil visualizar um futuro tão high-tech por aqui enquanto falta algo básico como oxigênio para vítimas da Covid-19. Mas a revolução genética já começou — e não podemos ficar de fora!


 Divertida Mente: as lições que o filme traz sobre autoconhecimento
Divertida Mente: as lições que o filme traz sobre autoconhecimento Da polpa à casca: conheça os benefícios do cajá
Da polpa à casca: conheça os benefícios do cajá Tecnologias à beira do leito ajudam a salvar vidas nas UTIs
Tecnologias à beira do leito ajudam a salvar vidas nas UTIs Os campeões do Prêmio Autocuidado em Saúde Acessa 2024
Os campeões do Prêmio Autocuidado em Saúde Acessa 2024 Febre oropouche: entenda a doença com sintomas parecidos com os da dengue
Febre oropouche: entenda a doença com sintomas parecidos com os da dengue