A biópsia líquida e a caça ao câncer pelo sangue
Novos testes ganham destaque nos estudos e na vida real, prometendo direcionar melhor o tratamento e, no futuro, até flagrar tumores mais cedo
O câncer é, antes de tudo, uma célula humana. Ou melhor, um emaranhado de células, com mutações genéticas que permitem a elas se multiplicar descontroladamente.
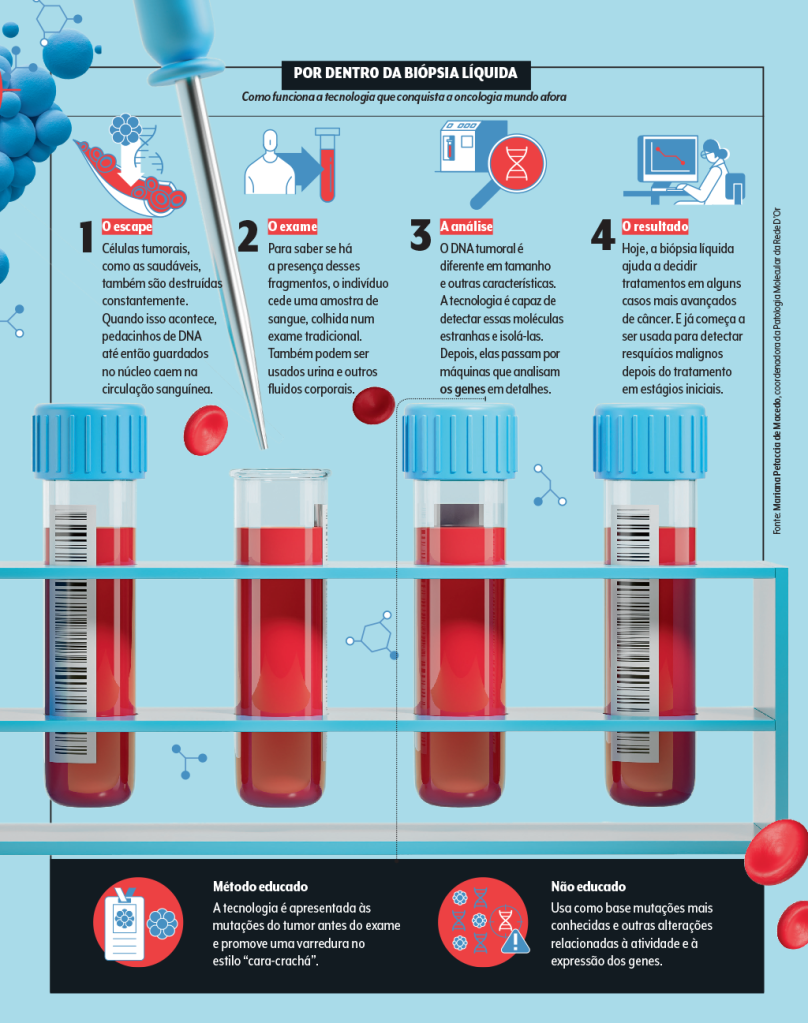
Como qualquer célula, aquelas que formam um tumor estão em contato constante com a corrente sanguínea, a fim de receber oxigênio e outros nutrientes… E enviar para a circulação matérias-primas úteis como proteínas e seus próprios restos mortais. Sim, a exemplo das demais, as células cancerosas também morrem.
E, seja pelo seu ciclo natural de vida, seja pelo ataque imunológico, elas são feitas em pedaços, o que inclui resquícios de DNA, até então guardadinhos no núcleo celular. No final, esses cacos podem ficar nadando pelo sangue.
Estima-se que certos tumores, a depender do seu estágio de evolução, secretem milhões de fragmentos de DNA a escoar pelos vasos. Um material que, diga-se, pode ser bastante valioso.
Nos últimos anos, a medicina vem se valendo dele para investigar, de maneira mais fácil, os segredos de um câncer. Tudo graças a um método chamado de biópsia líquida.
Ela já chegou aos hospitais, laboratórios e consultórios dos oncologistas, avança em estudos e está cada vez mais perto de ter seu uso ampliado no país. “Fazer um exame de sangue é muito mais simples do que fazer uma biópsia tradicional, que exige um corte no paciente. Então abrimos um leque de possibilidades”, diz o oncologista Paulo Hoff, presidente da Oncologia da Rede D’Or, que será a primeira a realizar todas as etapas do teste no Brasil.
Foram 80 milhões de reais em investimentos e anos de trabalho para nacionalizar a tecnologia e criar um laboratório de biologia molecular apto a essa finalidade.
+ Leia também: O papel da biópsia líquida no diagnóstico e no tratamento do câncer
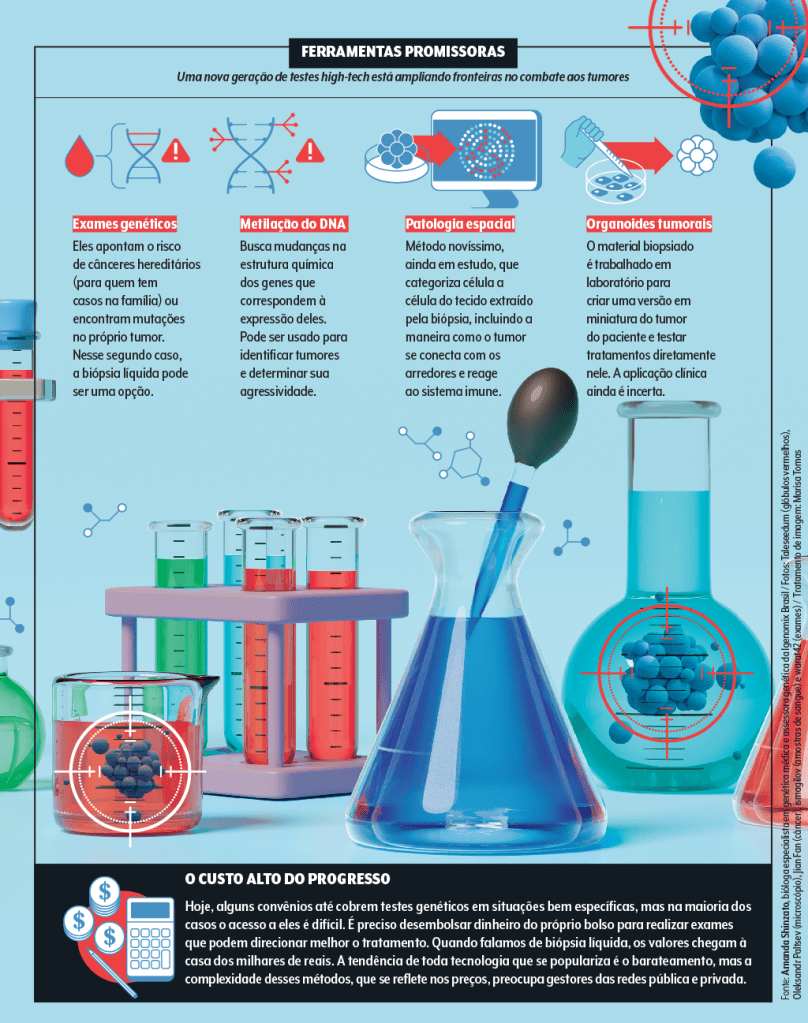
Além da biópsia líquida — que, aliás, é um termo genérico para uma série de técnicas —, a instalação em São Paulo irá oferecer testes genéticos e outros ainda mais modernos, como o de metilação do DNA e a patologia espacial (calma, explicaremos esses termos aparentemente estranhos mais adiante).
Antes de tudo, é imprescindível entender que o tratamento do câncer é decidido hoje a partir de análises minuciosas não só do local onde surgiu o tumor, mas de seu perfil genético e de como ele interage com o ambiente ao redor.
A biópsia líquida e outras abordagens menos invasivas descortinam essas peças, além de dar combustível a voos mais ousados, como a perspectiva de detectar tumores mais cedo, ver suas mudanças em tempo quase real e evitar tratamentos desnecessários. Exemplo icônico da tal medicina de precisão.
É um admirável mundo novo.
Só cabe lembrar que, hoje, qualquer análise detalhada do tumor ainda é feita preferencialmente por meio da biópsia como a conhecemos. Ou seja, é preciso retirar cirurgicamente uma amostra do tecido tumoral, que será preparado para ser inspecionado, inclusive do ponto de vista genético, e armazenado.
Ocorre que, com o câncer se tornando uma doença crônica, com a qual se convive por anos, pode ser necessário olhar para aquela amostra tempos depois. “O tumor começa de um jeito e termina de outro, porque adquire mutações no caminho”, conta Rodrigo Dienstmann, diretor médico da OC Precision Medicine, unidade especializada em análise patológica, genômica e big data da Oncoclínicas.
“A questão é que os tecidos extraídos por biópsia podem ficar mal preservados. Uma coleta de sangue está menos sujeita à variabilidade de processos”, compara o oncologista.
+ Assine VEJA SAÚDE a partir de R$12,90
Outra vantagem clara da biópsia líquida é obter informações do tumor quando ele está inacessível fisicamente ou mesmo evitar uma nova intervenção cirúrgica em pacientes debilitados.
“O melhor seria sempre ter o tecido em si, mas, na ausência dele, o método funciona suficientemente bem em mais de 80% das situações em que precisamos tomar decisões referentes a terapias personalizadas”, elucida Dienstmann.
E há ainda a possibilidade de ver além do procedimento convencional, ao tirar uma “média” do perfil das células malignas, já que o DNA do tumor todo, e não apenas de uma parte dele, pode escapar para a circulação sanguínea. Todas essas informações preciosas já estão sendo utilizadas na prática clínica em algumas situações.
A mais consolidada, inclusive do ponto de vista comercial, é a definição de tratamentos guiados por mutações genéticas em casos avançados de tumores de pulmão e próstata.
Mais recentemente, estudos referendam uma nova utilidade, que também já começa a cair nas graças dos médicos, a da análise de doença residual mínima — isto é, saber mais cedo se a cirurgia de retirada do tumor deu certo e se é preciso intensificar o tratamento. E pode ser que, em breve, tenhamos no mercado exames de sangue que prometem apoiar o rastreamento de tumores.
É o caso da tecnologia que virou notícia ao prometer flagrar “mais de 50 tipos de câncer” antes de eles causarem sintomas. Cenário animador, mas ainda cercado de dificuldades técnicas e econômicas a serem superadas antes de ferramentas do tipo integrarem o check-up.
Entre elas, o número de falsos positivos e negativos, o alto custo e a incerteza de transpor achados genômicos para a realidade da doença de cada paciente.
Por dentro da biópsia líquida
Enquanto guia os jornalistas em uma visita pelas instalações do novo laboratório da Rede D’Or, o patologista Fernando Soares, diretor médico do Departamento de Anatomia Patológica da instituição, diz orgulhoso: “Tem um Prêmio Nobel aqui, outro aqui, outro ali…”
Ele se refere às máquinas que, por fora, nada têm de atraentes — mais parecem grandes fotocopiadoras —, mas que materializam progressos notáveis na medicina, muitos deles oriundos do trabalho incansável de cientistas laureados. Por meio desses aparelhos, é possível ler as informações de algo tão microscópico como as moléculas de DNA e RNA.
Com a inauguração do espaço, que atenderá os pacientes da própria Rede D’Or, os especialistas irão obter o sequenciamento completo do tumor (a “tradução” do código genético dele) em 14 dias. “Alguns exames, que hoje podem demorar meses, serão feitos em semanas ou dias”, revela Soares.
+ Leia também: Novas fronteiras no cerco ao câncer
A menina dos olhos é a biópsia líquida, um termo genérico para a dosagem de biomarcadores em fluidos corporais, como sangue, urina e líquor. A técnica que tem ganhado mais destaque na área é a análise do DNA tumoral circulante, aqueles pedacinhos que escapam para a corrente sanguínea.
Vejamos o caso do câncer de pulmão. Há dez anos, ele era tão difícil de tratar quanto o de pâncreas. Hoje, é praxe, pelo menos na rede privada, realizar inquéritos genéticos para detectar mutações na hora de escolher o tratamento. A principal delas, encontrada em cerca de 25% dos casos, está no gene EGFR.
Por que é importante saber disso? “O médico tem à disposição drogas específicas para indivíduos cujo tumor tem alterações nesse gene”, responde o doutor em genética e biologia molecular Gabriel Macedo, também da Rede D’Or.
Depois de algum tempo, porém, o paciente pode deixar de responder ao tratamento e a doença volta a atacar. “Nessa situação, a biópsia líquida ajuda a detectar se houve uma nova mutação, para a qual já temos um medicamento bem específico, com altas chances de sucesso”, complementa Hoff.
História semelhante se dá com o tumor de próstata com metástase para o osso — isto é, quando a doença se dissemina da glândula para a coluna e outras regiões.
Um tipo de mutação no gene BRCA torna a doença mais tratável, mas não é possível fazer a análise no tecido ósseo colhido pela biópsia tradicional e nem sempre dá para examinar uma amostra da próstata em si, porque a doença tem evolução lenta — às vezes são décadas entre o diagnóstico inicial e o agravamento do quadro.
É nessas situações que a biópsia líquida já virou uma alternativa de consenso hoje. A próxima fronteira deverá ser o uso diante de tumores no intestino.
Geralmente, o indivíduo diagnosticado com câncer de cólon em estágio inicial, quando ainda não há metástase, passa por uma cirurgia para a retirada do tumor e, em alguns casos, faz quimioterapia para evitar sua volta. Mas ainda há muita discussão sobre a real necessidade dessa intervenção, digamos, preventiva.
Em um estudo com 455 pacientes, divididos em dois grupos, parte seguiu o protocolo-padrão, com o médico decidindo se era ou não um caso para a químio, parte realizou uma biópsia líquida — que neste caso fez uma busca por mutações específicas no DNA tumoral circulante, evidenciadas previamente por uma biópsia tradicional.
Essa informação guiou a decisão entre fazer ou não a terapia extra. No fim das contas, ambos os grupos tiveram resultados semelhantes.
Ou seja, o método evitou uma intervenção desgastante, com efeitos colaterais, sem prejudicar o prognóstico. “Muitas vezes, o paciente fica curado com a cirurgia, e damos um tratamento que pode não servir para nada. Seria fantástico evitar isso”, avalia Dienstmann. Não raro menos pode ser mais.
Missão: diagnóstico precoce
Em junho deste ano, um trabalho apresentado no congresso da Sociedade Americana de Oncologia Clínica (Asco, na sigla em inglês) ganhou manchetes mundo afora. “Exame detecta mais de 50 tipos de câncer” era o que dizia a maioria delas.
Tratava-se do Galleri, painel produzido pela companhia americana Grail, que foi testado no sistema de saúde britânico. Segundo os dados divulgados, o método diagnosticou dois em cada três casos de câncer em cerca de 5 mil pessoas com sintomas suspeitos na Inglaterra e no País de Gales. O exame se mostrou capaz, ainda, de identificar corretamente a localização do tumor, com precisão ao redor de 90%.
+ Assine VEJA SAÚDE a partir de R$12,90
Que sonho, não? Um simples exame de sangue que poderia, um dia, substituir uma mamografia ou colonoscopia. É o que prevê o fabricante, em cima de modelos matemáticos que simulam o cenário de vida real e calculam reduzir em 25% as mortes por câncer.
Porém, como diz o ditado, devagar com o andor. O método ainda está sendo estudado e não foi aprovado por nenhuma agência regulatória — a utilização, mesmo em hospitais, ocorre em regime experimental. O Reino Unido conduz no momento uma pesquisa com 140 mil indivíduos para verificar a utilidade da estratégia: ou seja, quanto ela de fato flagra as doenças mais cedo e poupa dissabores aos pacientes.
Embora seja empolgante, a capacidade da biópsia líquida de endereçar o diagnóstico precoce ainda é terreno pantanoso.
No mesmo encontro da Asco, o filósofo especializado em bioética Leonard Fleck, professor da Universidade Estadual de Michigan, também nos Estados Unidos, classificou os anúncios relacionados ao Galleri como otimistas demais e destacou alguns problemas, entre eles o fato de interferir tão cedo num câncer que os especialistas nem sabem se realmente se desenvolverá.
Por isso, Fleck liderou uma revisão sistemática da literatura a respeito e concluiu que “a validade clínica do exame é, no máximo, marginal”.
Não que a ideia por trás do Galleri e de outros multi-cancer early detection tests (MECDs, como têm sido chamados) seja desprezível. Hoje muitos dos tumores não são rastreáveis com protocolos como os da mamografia ou do papanicolau, e mesmo nesses casos não há 100% de acerto, sem falar que são métodos que dependem de infraestrutura e se revelam inacessíveis a uma parte da população.
Seria ótimo resolver tudo com umas gotinhas de sangue. Mas os especialistas avaliam que ainda estamos distantes desse mundo ideal. No último estudo com o Galleri, publicado no periódico The Lancet, foram apuradas amostras de 6 mil pessoas sem sintomas. Desta vez, 1,4% dos voluntários tiveram resultado positivo (92 deles), sendo 35 pacientes de verdade (já diagnosticados de forma tradicional) e 57 se mostraram falsos positivos.
“O problema dos falsos positivos é levar a outros tantos exames, com impacto na vida da pessoa e custos para o sistema”, raciocina a bióloga Dirce Carraro, do Grupo de Genômica e Biologia Molecular do A.C.Camargo Cancer Center, em São Paulo. “Vejo utilidade na proposta, mas falta muito estudo para entender qual será ela”, conclui a pesquisadora.
O ponto da discussão é: em estágio ainda indetectável, uma quantidade muito pequena de DNA tumoral cai em circulação.
E aí é como procurar uma agulha no palheiro, e imaginando que essa agulha pode ser comprida, curta, grossa, fina, a depender de seu perfil genético… O teste tem que estar preparado para tudo. Haja refinamento! As técnicas mais consolidadas hoje recebem instruções precisas sobre o que procurar, com a localização de mutações específicas de cada paciente.
A tecnologia do Galleri e exames afins é a análise do perfil de metilação do DNA. De um modo bem resumido, é como se ele não visualizasse a ordem das letrinhas que formam o genoma, mas a sua composição química, com o objetivo de entender como os genes se expressam ou quão ativos (ou inativos) estão.
É uma estratégia inteligente. “O padrão de metilação pode estar associado a diversos tumores”, explica Dirce. Tanto que, em outros contextos, a metodologia já oferece pistas mais confiáveis e com aplicação clínica. “Em tumores do sistema nervoso central de difícil identificação, essa análise ajuda a caracterizar o tipo de câncer e sua agressividade”, exemplifica Soares. “Esperamos que, no futuro, o raciocínio possa ser expandido para outras doenças.”
A ver.
Made in Brazil
Tecnologias como a biópsia líquida nos recordam dos déficits de acesso a exames e tratamentos inovadores no país, sobretudo no sistema público. Mas há uma mobilização para mudar as coisas.
Fora o novo laboratório da Rede D’Or, a startup nacional Sthorm anunciou o lançamento de um exame de sangue de baixo custo para identificar tumores de mama.
Segundo a healthtech, ele teria alta precisão em comparação com a mamografia (o padrão ouro). “Para chegar a essa conclusão, conduzimos testes com mais de 400 brasileiras”, afirma o farmacêutico Tiago Silva, sócio da empresa e um dos criadores do produto.
Ele faz suspense sobre detalhes dos estudos, mas adianta que o exame será cerca de 30% mais barato que a mamografia. No entanto, a ideia não é substituí-la, e sim agilizar a triagem de pacientes. “Estima-se que 30 milhões de mulheres deveriam fazer a mamografia regularmente, mas só 7 milhões se submetem a ela. O resultado é que o governo gasta 4 bilhões de reais a mais anualmente por não diagnosticar tumores no tempo adequado”, contextualiza Silva.
O teste da Sthorm será submetido à Anvisa e pode chegar ao mercado em 2024.
+ Leia também: EUA recomendam mamografia a cada 2 anos para mulheres a partir dos 40 anos
Claro, qualquer nova tecnologia precisa ser validada pela comunidade científica e por órgãos regulatórios antes de prestar serviço ao público. E, ainda que possam ajudar a democratizar o acesso a uma saúde de qualidade, os custos elevados, pelo menos no primeiro momento de implementação, acabam deixando muita gente de fora.
Hoje, a biópsia líquida não é coberta por convênios nem pelo SUS. “Mas o uso já deveria ser ampliado ao menos nas aplicações em que há mais evidências de benefício, como no câncer de pulmão”, argumenta Clarissa Baldotto, presidente do Grupo Brasileiro de Oncologia Torácica (GBOT).
O desafio é grande: a oncologista lembra que mesmo as avaliações genéticas mais consagradas na biópsia convencional, cujos achados auxiliam a salvar vidas, não estão à disposição de milhares de brasileiros. Nesse sentido, temos muito, mas muito, a evoluir.
Fontes complementares: Amanda Shinzato, bióloga especialista em genética médica e assessora genética da Igenomix Brasil; Mariana Petaccia de Macedo, coordenadora da Patologia Molecular da Rede D’Or


 Excesso de magnésio: entenda quadro de Isabel Veloso, que está na UTI
Excesso de magnésio: entenda quadro de Isabel Veloso, que está na UTI Tirzepatida: como saber se é falsa e como não cair em ciladas
Tirzepatida: como saber se é falsa e como não cair em ciladas Lava-roupas da marca Ypê são recolhidos por contaminação com bactéria; veja os lotes
Lava-roupas da marca Ypê são recolhidos por contaminação com bactéria; veja os lotes “Mounjaro do Paraguai”: entenda os riscos de canetas emagrecedoras sem regulamentação
“Mounjaro do Paraguai”: entenda os riscos de canetas emagrecedoras sem regulamentação 10 mil calorias por dia: influenciador fitness morre tentando “engordar rápido”
10 mil calorias por dia: influenciador fitness morre tentando “engordar rápido”


















